化学計算の基本 モル、気体の体積、原子数
ブログをご覧の皆さん、こんにちは。
今日も化学に関する記事を紹介したいと思います。
放射線取扱主任者試験では、化学の教科では基本的な計算問題も多々出題されます。
発生する気体の体積や原子数を求める計算問題などです。
高校化学で習ったかと思いますが、
気体の体積や原子数を計算するにはモル数に関して理解しなくてはなりません。
Wikipediaでは、モルは
「モルは、本来は全ての物質は分子よりできているとの考えの元に、その物質の分子量の数字にグラムをつけた質量に含まれる物質量を1モルと定義した。例えば酸素分子の分子量は32.0なので、1molの酸素分子は32.0 gとなる」
と書かれています。
発生する気体の体積や原子数を求める計算問題などです。
高校化学で習ったかと思いますが、
気体の体積や原子数を計算するにはモル数に関して理解しなくてはなりません。
Wikipediaでは、モルは
「モルは、本来は全ての物質は分子よりできているとの考えの元に、その物質の分子量の数字にグラムをつけた質量に含まれる物質量を1モルと定義した。例えば酸素分子の分子量は32.0なので、1molの酸素分子は32.0 gとなる」
と書かれています。
モル
ある物質の1モル(1mol)はその物質の分子量にgをつけた質量になります。
例えば、
炭酸ガスCO2(分子量12+16×2=44)1モルは44g
塩化水素HCl(分子量1+35.5=36.5)1モルは36.5g
気体の体積
化学の試験で出題される形式は、「標準状態で発生する放射性気体の体積はいくらか」という問題が多いかと思います。
ある物質の1モル(1mol)はその物質の分子量にgをつけた質量になります。
例えば、
炭酸ガスCO2(分子量12+16×2=44)1モルは44g
塩化水素HCl(分子量1+35.5=36.5)1モルは36.5g
気体の体積
化学の試験で出題される形式は、「標準状態で発生する放射性気体の体積はいくらか」という問題が多いかと思います。
標準状態とは0℃、1気圧(1atm)の状態をいいます。
同じ物質量であれば気体の体積はその種類に関係なく同温・同圧では同じ体積になります。ほとんどの気体1モルの体積は標準状態では22.4Lになります。1L=1000mLなのでmLで表すと22.4L=22400mLとなります。

炭酸ガスでも塩化水素ガスでも1モル発生した場合の気体の体積は22.4Lになります。もし、0.1モル発生したらならば、0.1モル×22.4L=2.24Lになりますね。
炭酸ガスでも塩化水素ガスでも1モル発生した場合の気体の体積は22.4Lになります。もし、0.1モル発生したらならば、0.1モル×22.4L=2.24Lになりますね。
原子数
どんな物質でも1モルの原子数(分子数)は6.02×1023個になります。
この6.02×1023の数字をアボガドロ数と言います。
ある物質の質量gが分かっていれば、その質量をその物質の分子量で割ることでモル数が分かります。そして、そのモル数にアボガドロ数6.02×1023を掛けることで原子数(分子数)が計算できます。
以前、2月9日の記事で放射能を求める式について紹介しました。

放射能は定義(第7版放射線概論P.130)から、
ある物質の質量gが分かっていれば、その質量をその物質の分子量で割ることでモル数が分かります。そして、そのモル数にアボガドロ数6.02×1023を掛けることで原子数(分子数)が計算できます。
以前、2月9日の記事で放射能を求める式について紹介しました。
放射能は定義(第7版放射線概論P.130)から、
の式で表されますが、この式でNが原子数を表し
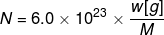
壊変定数λが、
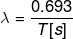
壊変定数λが、
となります。
モル数、標準状態の気体の体積、原子数に関しては、化学の試験でも時々出題されていますので過去問題を解いて必ず自分で計算できるようにしておいて下さい。
モル数、標準状態の気体の体積、原子数に関しては、化学の試験でも時々出題されていますので過去問題を解いて必ず自分で計算できるようにしておいて下さい。
気体の体積
平成17年度化学問5
平成18年度化学問5
平成20年度化学問6
平成21年度化学問4
平成26年度化学問21
平成29年度化学問3
平成30年度化学問4
原子数
平成17年度化学問7
平成19年度化学問6
平成20年度化学問5
平成22年度化学問4
平成23年度化学問5
平成24年度化学問2
平成26年度化学問5
平成27年度化学問7
平成30年度化学問2
沈殿
平成29年度化学問17,18