ブログをご覧の皆さん、こんにちは。
先日は化学分離に関する記事を掲載し、昨日は化学分離の中で溶解度に関する過去問題をいくつか掲載しました。
今日は溶媒抽出法に関する過去問題をいくつか掲載いたしますので、是非解いてみて下さい。溶媒抽出法に関しては今年度に入ってからも一度記事(溶媒抽出法)にしており、その記事内でもいくつか過去問題を掲載しています。今日はそこに掲載していない過去問題を中心に挙げてみました。
溶媒抽出法は計算問題も多く出題されています。
分配比D、抽出率Eの定義をしっかりと覚え、過去問題の計算問題を解いておけば決して難しくはありません。
第一種試験
化学
2005年度問23
図はFe(II, III)及びCo(II)の塩酸溶液陰イオン交換樹脂の間の分配係数D(固相/液相)を示している。塩酸溶液中の55Fe、60Coの分布挙動に関する次の記述のうち、正しいものの組合せはどれか。
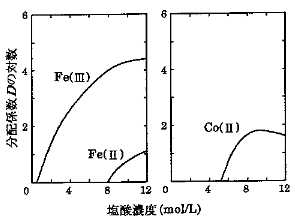
A 塩酸濃度を4mol/Lとして陰イオン交換樹脂カラムに流すと、60Co(II)は
ほとんど通過する。
B 塩酸濃度を10mol/Lとして陰イオン交換樹脂カラムに流すと、59Fe(III)は
ほとんど通過する。
C Fe(III)をすべてFe(II)に還元すると、59Feは陰イオン交換樹脂により強く
吸着する。
D 59Fe(III)と60Co(II)を吸着した陰イオン交換樹脂に8mol/Lの塩酸を流す
と、59Feを分取することができる。
E 59Fe(II)と60Co(II)を吸着した陰イオン交換樹脂に3mol/Lの塩酸を流す
と、59Feと60Coの両方を溶離することができる。
2007年度問19
溶媒抽出法に関する次の記述のうち、正しいものの組合せはどれか。
A 125I-をI2と同位体交換させて有機溶媒に抽出する。
B 65Zn2+をジチゾン錯体として有機溶媒に抽出する。
C 59Fe3+をクロロ錯体としてイソプロピルエーテルに抽出する。
D 137Cs+をクエン酸錯体として有機溶媒に抽出する。
2010年度問19
水溶液中にイオンとして存在する放射性核種の有機相への溶媒抽出法に関する次の記述のうち、正しいものはどれか。
1 有機溶媒によってイオンの酸化数が変化することを利用する分離方法
である。
2 イオンの抽出速度が遅いので通常は1時間以上激しく撹拌する必要があ
る。
3 イオンとキレート化剤から生成する中性の錯体が抽出される。
4 アセトンやエタノールも抽出溶媒として利用する。
5 比重が1より大きい有機溶媒は利用できない。
2019年度化学問31
(略)
一方、溶媒抽出法とイオン交換法は、2つの異なる相の間で元素が(J)される現象を利用した分離法で、トレーサー量の元素に対しても適用可能である。
計算問題
2006年度問23
右図はある溶媒抽出系におけるEu(III)とAm(III)の分配比(D)の特性を示す。Eu(III)とAm(III)を等量含む試料があるとき、この溶媒抽出系を利用してEu(III)の除去率90%以上、Am(III)の回収率90%以上の試料を得たい。抽出時の水相硝酸濃度(mol/L)として最も適切な値は次のうちどれか。ただし、抽出操作は1回のみ行うものとする。

2009年度問19
水相中の放射性同位元素X(110MBq)を有機相へ溶媒抽出する際に、Xの分配比(有機相中濃度/水相中濃度)が10のとき、次の記述のうち、正しいものの組合せはどれか。
A 有機相の容積が水相の10倍の場合、Xの水相の放射能は100MBqとな
る。
B 有機相と水相の容積が等しい場合、Xの有機相の放射能は100MBqとな
る。
C 有機相の容積が水相の1/10の場合、Xの抽出率は50%となる。
D 有機相の容積が水相の1/2の場合、Xの抽出率は25%となる。
2011年度問24
水溶液中の化合物Xをある有機溶媒で抽出すると、Xの分配比(有機相中濃度/水相中濃度)は80である。50kBqの放射性同位体で標識したXの水溶液から、水相の1/2の体積の有機溶媒でXを抽出したとき、水相に残るXの放射能[kBq]に最も近い値は次のうちどれか。
2012年度問25
水相からある有機相へのI2の抽出の分配比が100であった。50MBqの125IをI2として含む水相100mLから、このI2を有機相50mLに抽出した場合、水相に残る125Iの放射能[MBq]に最も近い値は次のうちどれか。
2014年度問23
有機相と水相との分配比が50の放射性の化学種があり、その化学種を含む水溶液の放射能は100MBqである。水相と等容積の有機相で溶媒抽出した場合に、水相に残る放射能[MBq]として最も近い値は次のうちどれか。
2015年度問19
ある有機化合物を溶媒抽出する場合、放射性化合物の有機相中の濃度が水相の濃度の10倍であった。この化合物の放射能が100MBqであるとき、その95MBqが有機相に抽出された。このとき、有機相(o)と水相(w)の容積比(Vo/Vw)として最も近い値は次のうちどれか。
2017年度問20
ある化学種に対する有機溶媒(O)と水(W)の間の分配比(O/W)は4である。その化学種(100MBq)を含む水溶液に同体積の有機溶媒を加えて抽出した。有機溶媒を取り除き、残った水溶液に同体積の新たな有機溶媒を加えて再び抽出した。2回の操作で有機溶媒に抽出された化学種の放射能の総量[MBq]として最も近い値は次のうちどれか。
物化生
2007年度問4Ⅰ
イオン交換樹脂に用いる分離系では、吸着の強さを表す指標として分配係数が用いられる。U(VI)イオンを例にとると、吸着平衡の時にイオン交換樹脂に吸着したU量が1.0×104Bq・g-1(乾燥樹脂重量)、水溶液に残ったUの濃度が5Bq・ml-1の時、分配係数は2.0×103である。
それぞれ1.0×104Bqの137Cs(I)、51Cr(III)、95Zr(IV)の各イオンのトレーサーを含む0.2MH2SO4水溶液10mlがある。その溶液に、陰イオン交換樹脂1g(乾燥重量)を加えてから、良く攪拌して吸着平衡にした。この系におけるそれぞれのイオンの分配係数を求めたところ、次表に示す値が得られた。

95Zr(IV)は、そのほとんどが(A)。溶液中の95Zr濃度は約(B)Bq・ml-1となった。137Cs(I)はほとんどが(C)。137Cs(I)は溶液中で(D)として存在していると考えられる。51Cr(III)では、95%が水溶液中に見出され、その分配係数はおよそ(E)であった。
2007年度問4Ⅱ
溶媒抽出法では、溶質の抽出特性を表す指標として分配比が用いられる。有機相中の溶質の全濃度をCO、水相中のそれをCAとすると、分配比は(A)で表される。通常は有機相への抽出を増すために(B)等の抽出剤を有機相に加える。有機相を 30%リン酸トリブチル/n-ドデカン、水相を硝酸溶液とした時の、いくつかの金属元素について分配比を表に示す。

等容積の有機相と3M硝酸溶液を用いた1回の抽出では、U(VI)は(C)%が有機相に抽出され、Eu(III)とTC(VII)は(D)%が水相に残ることがわかる。この水相に対して、新たに等容積の有機相を用いて2回目の抽出を行うと、水相中に残るU(VI)量は、最初に存在した量の(E)%となる。
2008年度問4Ⅲ
RIの分離において、溶媒抽出法は有用な方法の一つである。いま、1.0kBqの59Fe(III)及び1.0MBqの65Zn(II)を含む6M塩酸溶液100mlに、イソプロピルエーテル100mlを加えて振り混ぜ、59Feを有機相に抽出する。この系でのFe(III)とZn(II)の分配比が下表のような値であるとき、有機相中の59Feの放射能は(A)kBq、65Znの放射能は(B)kBqとなる。したがって、有機相の全放射能に占める59Feの放射能の割合は(C)%である。
次に、この有機相から水相を完全に除去した後、RIを含まない新たな6M塩酸溶液100mlを加え、同じ操作を繰り返すと、有機相中の65Znの放射能は(D)kBqとなり、有機相の全放射能に占める59Feの放射能の割合は(E)%である。

2016年度問3Ⅱ
液体-液体間の放射性核種の分配平衡を利用した分離法としては溶媒抽出法がある。水溶液中に電気的に中性な分子を形成させ、これが有機溶媒中に移動することで抽出が進行する。キレート抽出とイオン会合体抽出に大別される。キレート抽出試薬には(J)やβ-ジケトンのトリフルオロアセチルアセトンなどがある。特定の金属イオンと錯イオンを形成しやすい(K)やCN-などを(L)として添加することにより、水相に特定の成分を保持することもしばしば行われる。イオン会合体抽出の例としては、濃塩酸溶液からのFe3+の(M)による抽出が知られている。
(略)